2025年1月23日,《Cell》期刊在線發表了題為《成年哺乳動物大腦皮層和海馬內源NMDA受體的組裝和結構》的研究論文,該研究由中國科學院腦科學與智能技術卓越中心(神經科學研究所)竺淑佳研究組和上海藥物研究所李揚研究組合作完成。研究團隊通過提取大鼠大腦皮層和海馬中的內源NMDA受體并解析出3種主要亞型及比例,揭示內源NMDA受體的原子分辨率三維結構,突破了NMDA受體的分子結構與功能研究局限于異源重組表達系統的瓶頸。該成果為開發靶向NMDA受體治療神經或精神類疾病的新型藥物提供了重要的理論基礎。
學習和記憶是人類認知和感知世界的高級腦功能,突觸可塑性的改變被認為是學習和記憶的物質基礎。N-甲基-?-天冬氨酸(N-methyl-?-aspartate,簡稱 NMDA)受體是一類存在于突觸上的離子型谷氨酸門控通道家族,廣泛參與神經發育、突觸可塑性、學習記憶、認知及情緒等高級腦功能調控,被視為學習和記憶的關鍵“分子開關”。NMDA受體在負責學習和記憶相關高級認知功能的腦區(如大腦皮層和海馬)發揮著至關重要的作用,受體通道對鈣離子具備高通透性,根據突觸活動的強弱調控突觸連接的強度,并參與下游信號介導基因的表達和新突觸的形成。近年來的臨床醫學研究揭示NMDA受體功能障礙直接與一系列神經及精神疾病密切相關,包括NMDA受體突變相關的罕見病、癲癇、精神分裂癥和自身免疫性腦炎等。因此,NMDA受體一直是腦疾病領域藥物設計最熱門的靶點,已有靶向NMDA受體的分子(如氯胺酮、美金剛、右美沙芬)用于臨床治療抑郁癥和阿爾茨海默癥。
在哺乳動物中,NMDA受體由7個不同基因編碼形成7個不同亞基。有功能的NMDA受體通常由兩個必需的GluN1亞基和兩個可變的GluN2/3(N2A-N2D,N3A-N3B)亞基組裝形成二異或三異四聚體(圖1)。過去十年內,利用體外重組表達系統,NMDA受體亞型的結構與功能已被大量解析,其中竺淑佳研究組在該領域也取得了系列進展(Cell 2016; Cell Rep 2018; Nature 2021; Neuron 2021; Nat Struct & Mol Biol 2023, 2024)。然而,大腦中內源NMDA受體的亞基表達和受體組裝受到嚴格的大腦發育時空變化調控。腦內調控學習與記憶的是哪些內源NMDA受體,它們在大腦中的占比是怎樣的,它們的組裝形式和已知的異源重組受體是否存在差異,系列問題極大限制了對突觸分子功能的理解。
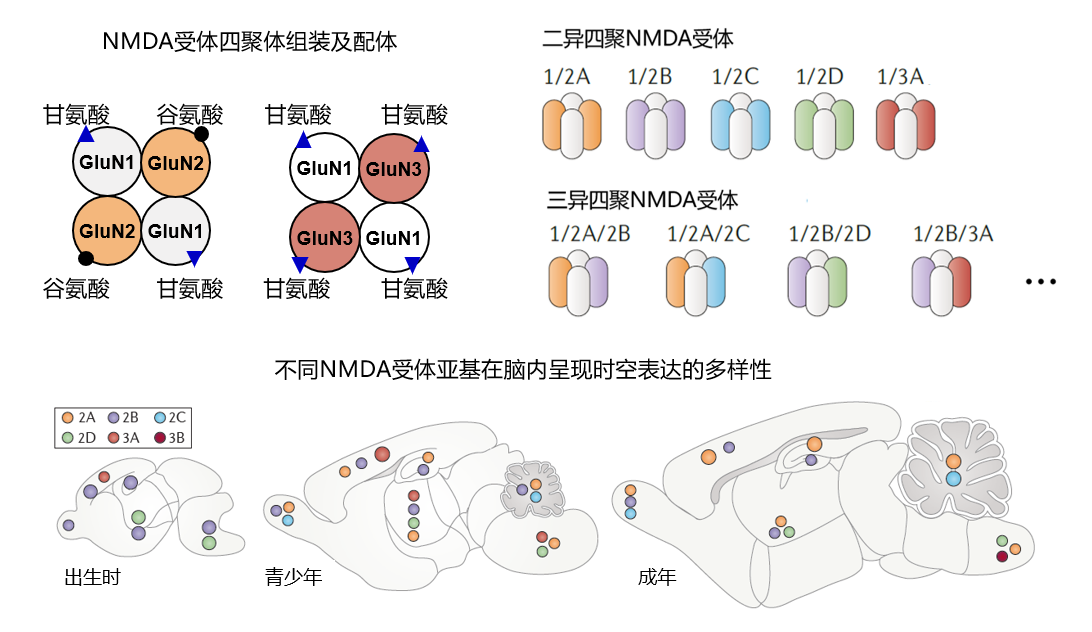
圖1. NMDA受體亞基時空表達和四聚體組裝的多樣性。功能性NMDA受體由兩個必需的GluN1亞基和兩個可變的GluN2或GluN3亞基組裝形成四聚體。在不同的發育階段,腦內關鍵NMDA受體不同亞型的分布及功能存在多樣性。
為了從腦組織中分離出內源NMDA受體,竺淑佳團隊通過多年的技術積累,定制了靶向各個NMDA受體亞基的構象特異性單克隆抗體。團隊通過異源重組表達的不同NMDA亞型蛋白逐一免疫小鼠,通過雜交瘤技術及活細胞染色篩選出了靶向NMDA受體各亞基的選擇性單抗(圖2)。借助這些實驗室自制的超高親和力抗體工具(親和力在納摩爾數量級),研究團隊成功從成年大鼠的大腦皮層和海馬中富集和分離出了豐度極低的內源NMDA受體。
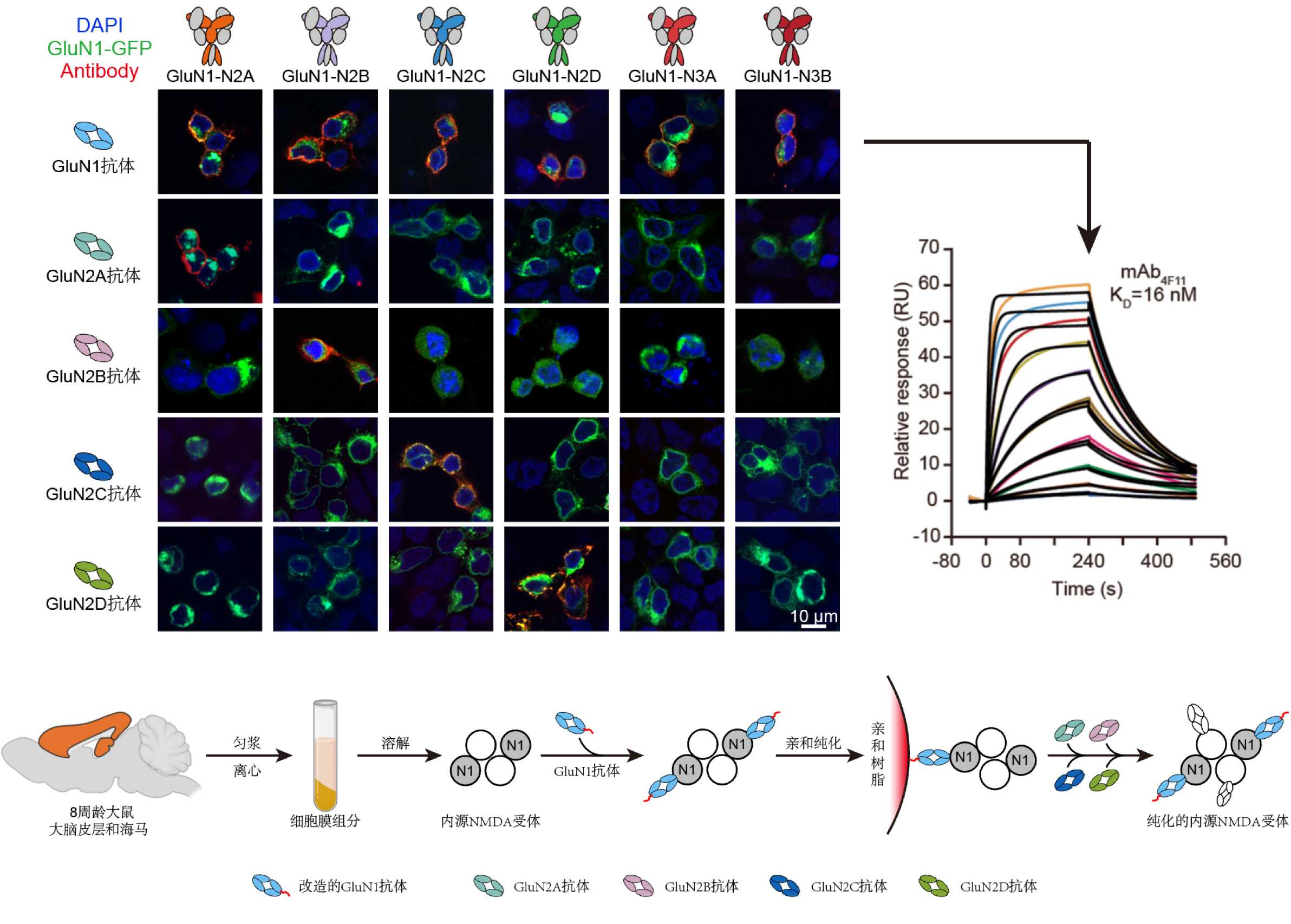
圖2. 靶向NMDA受體亞基的高親和力單抗的開發和內源NMDA受體的富集純化策略。雜交瘤技術及活細胞熒光成像方法制備及鑒定結合不同NMDA受體亞型的單克隆抗體。利用納摩爾級別的GluN1單抗純化出皮層海馬中內源NMDA受體,并加入構象特異性和亞基選擇性的GluN2抗體進行標記及分析。
通過冷凍電鏡(cryo-EM)技術,團隊從皮層和海馬中的內源NMDA受體解析出了3種主要的受體亞型:GluN1-N2A-N2B三異四聚體,GluN1-N2B和GluN1-N2A二異四聚體,分別占據45%,35%和20%的比例(圖3)。該研究表明GluN1-N2A-N2B三異四聚體是內源豐度最高的亞型,強調了GluN2A和GluN2B亞基在生理狀態同一受體中的功能整合。更新了領域內三十年來認為發育關鍵期(developmental switch)是從GluN1-2B轉變為GluN1-2A的觀點,應修正為從出生時GluN1-2B轉變為成年的GluN1-2A-2B, GluN1-2B和GluN1-2A三種亞型共存的結論。
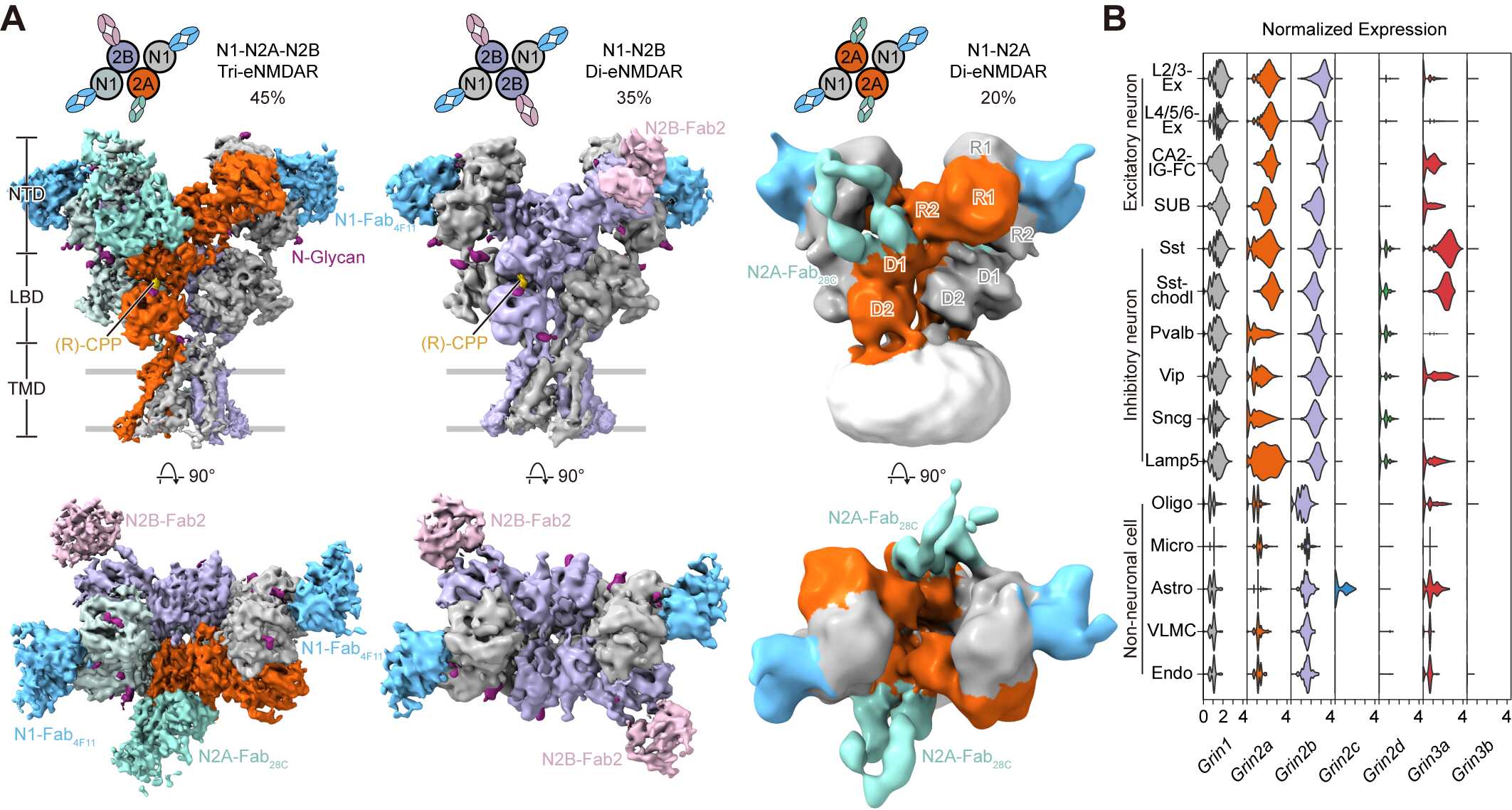
圖3. 皮層和海馬內源NMDA受體的主要亞型和不同亞基在單細胞轉錄組水平上的分布。
研究團隊進一步通過結構對比發現了GluN2B亞基在GluN1-N2A-N2B三異四聚體和GluN1-N2B二異四聚體中的構象區別,揭示了同一亞基在不同受體中存在構象差異,將決定不同亞型的生物物理學、藥理學和通道開放屬性(圖4)。不同內源NMDA受體間的構象差異,為理解內源NMDA受體的功能多樣性,以及不同受體的藥理差異提供了分子基礎。該發現為設計具有亞基特異性且具有亞型偏好性的化合物提供了可能,有助于提高NMDA受體藥物的靶向性。
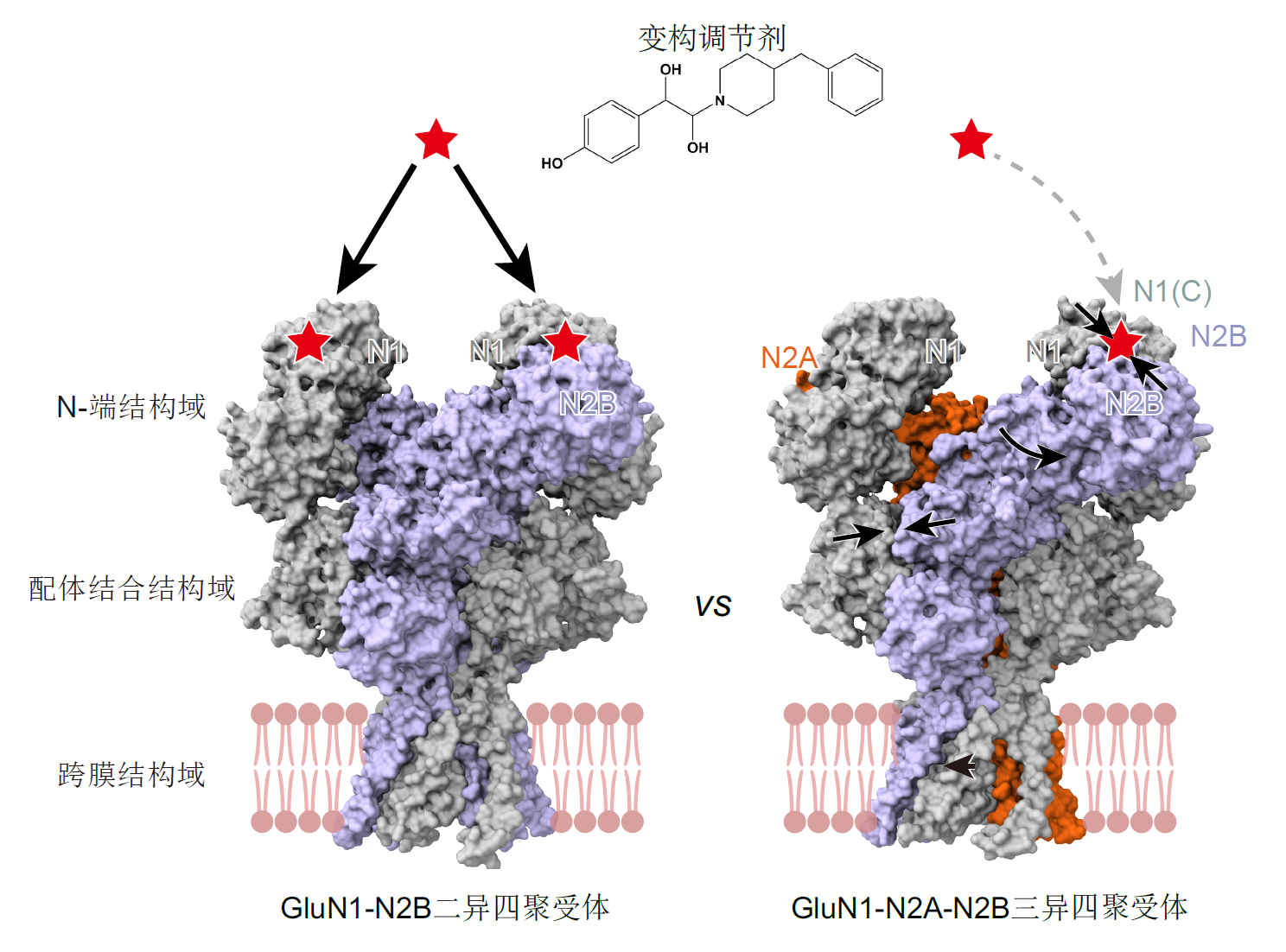
圖4. 內源NMDA受體亞型間的構象及藥理學特性差異。
該研究范式突破了幾十年來NMDA受體的分子結構局限于體外異源重組表達系統的瓶頸,首次在原子分辨率上“看到”調控哺乳動物學習和記憶的“分子開關”的精細結構,揭示了內源NMDA受體的組裝和組成,不僅加深了神經科學領域對NMDA受體介導的突觸可塑性、學習和記憶等生理功能的理解,更為后續研究基于NMDA受體功能障礙相關腦疾病的機制和治療,揭示靶向NMDA受體臨床藥物的在體作用機制奠定了重要的理論依據。
該論文第一作者張明是中國科學院腦智卓越中心和上海藥物研究所聯合培養的博士研究生。竺淑佳團隊的馮娟副研究員協助數據分析,謝春和宋楠制備并鑒定了亞基特異性抗體;北京蛋白質組中心的王建研究員和金超智完成了質譜鑒定;大連化物所趙群和張麗華研究員開展了交聯質譜分析;腦智卓越中心孫怡迪研究員和王波爽開展了轉錄組數據分析。該工作獲得了國家科技創新2030計劃、國家自然科學基金、中國科學院青年交叉團隊和上海分院青年攀登計劃、上海市科技重大專項等項目資助。

從左到右,竺淑佳(通訊作者),馮娟,張明(第一作者)

