2025年4月8日,中國科學院上海藥物研究所許葉春研究團隊聯合武漢病毒研究所張磊砢團隊在Advanced Science在線發表了題為“Dynamic Cap-Mediated Substrate Access and Potent Inhibitor Design of Monkeypox Virus I7L Protease”的研究論文。該論文首次報道了猴痘病毒I7L蛋白酶的高分辨率晶體結構,揭示其獨特的構象調控機制,并基于此成功設計和優化獲得納摩爾級共價抑制劑,為正痘病毒的廣譜抗病毒藥物開發提供了結構基礎和先導化合物。
猴痘病毒是一種長期在非洲流行的正痘病毒,因2022年引起全球暴發而被世界衛生組織列為全球公共衛生緊急事件。I7L蛋白酶在正痘病毒成熟過程中發揮關鍵作用,是備受關注的抗病毒藥物新靶點。然而,長期以來其底物識別機制不明、三維結構缺失、酶活檢測方法匱乏,嚴重妨礙了I7L抑制劑的研發進展。
首次報道猴痘病毒I7L蛋白酶晶體結構,揭示“構象開關”機制
本項研究中,研究團隊解析了猴痘病毒I7L蛋白酶高分辨率晶體結構,發現其以穩定的二聚體形式存在,具備高度保守的催化三聯體。在活性位點附近,團隊首次解析并捕捉到一個柔性的帽狀結構區域(cap region),可在“開啟”與“閉合”兩種構象間發生動態轉換,有效調控底物進入活性中心。結合多個晶體結構的解析和分子動力學模擬研究,證實該帽狀結構作為I7L蛋白酶中的“構象開關”,在底物結合過程中發揮核心調節作用。該研究不僅填補了正痘病毒蛋白酶三維結構研究的空白,更在原子層面為基于結構的精準藥物研發提供了全新思路。
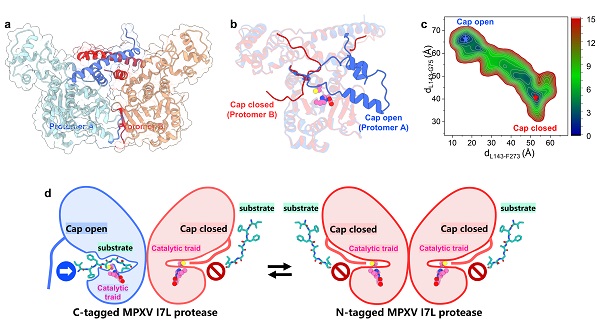
圖1. 猴痘病毒I7L蛋白酶晶體結構及帽狀結構區域的動態構象調控機制
(a)猴痘病毒I7L蛋白酶二聚體。(b)晶體結構捕捉到的帽狀結構區域的兩種不同構象。(c)分子動力學模擬揭示的I7L蛋白酶的構象分布。(d)I7L蛋白酶的帽狀結構調控底物結合示意圖。
闡明I7L蛋白酶底物識別與催化水解機制,設計強效抑制劑
在結構解析基礎上,研究團隊結合AlphaFold3復合物結構預測與QM/MM 分子動力學多尺度模擬,系統揭示了I7L蛋白酶的底物識別規律和催化水解機制,明確了I7L蛋白酶S1–S5亞位點的關鍵作用,并揭示去酰化(E-1 → E:P)為催化反應的限速步驟。
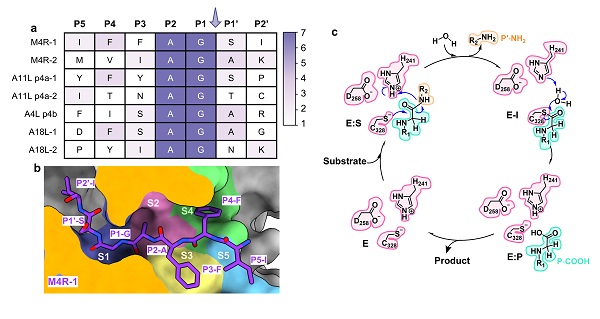
圖2. 猴痘病毒I7L蛋白酶底物識別與催化反應的分子機制
(a)猴痘病毒的底物序列(P5–P2')及保守性分析。(b)AlphaFold3預測底物M4R-1與猴痘病毒I7L蛋白酶的結合模式。(c)基于QM/MM 分子動力學模擬計算揭示的猴痘病毒I7L蛋白酶催化水解底物機制。
基于上述機制解析,研究團隊進一步設計了模擬天然底物的一系列共價抑制劑,采用臨床應用共價藥物中的氰基作為共價彈頭,并建立了基于熒光共振能量轉移(FRET)的高通量酶活測試方法進行化合物的抑制活性評價,成功鑒定出多個具有納摩爾級抑制活性的I7L抑制劑。其中,化合物11展現出卓越的抑制活性,它在酶水平抑制猴痘病毒I7L蛋白酶的IC50為69 nM。在細胞水平,化合物11有效抑制痘苗病毒復制,EC50為6.0 μM,且在400 μM濃度下未觀察到明顯的細胞毒性(CC50 > 400 μM)。
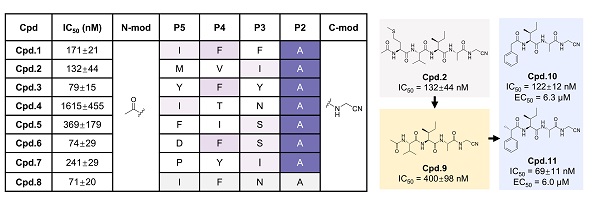
圖3. 基于結構的猴痘病毒I7L蛋白酶抑制劑的設計
進一步多序列比對分析揭示,I7L蛋白酶在正痘病毒屬中呈現跨物種高度保守,且在猴痘病毒不同進化分支(clade I、IIa、IIb)間同樣保持極高的序列一致性。結構分析顯示關鍵的藥物結合位點無突變,提示研究團隊所開發的抑制劑具備廣譜抗正痘病毒的潛力。
許葉春研究團隊長期致力于靶向病毒蛋白酶的廣譜抗病毒藥物研發,構建了結構藥理學與計算機輔助藥物設計深度融合的早期藥物發現關鍵技術體系。團隊以精準解析的藥效構象為基礎,理性設計并高效優化獲得先導化合物及候選藥物。作為主要發明人之一,合作研發了抗新冠病毒創新藥物先諾欣。此外,研究團隊近年來在國際頂尖期刊上發表多項創新性的抗病毒相關研究成果(J. Am. Chem. Soc. 2024,Nat. Commun. 2023,Chem. Sci. 2023,Nat. Sci. Rev. 2023,Signal Transduct. Target. Ther. 2023,Angew. Chem. Int. Ed. 2022,Nat. Commun. 2021,Science 2020a,Science 2020b)。
上海藥物所蘇海霞研究員、臨港實驗室博士生鄔國慶、杭州高等研究院博士后熊慕雅、南京中醫藥大學/上海藥物所聯合培養碩士生王宇航、武漢病毒所博士后曹浚垣為本文的共同第一作者,上海藥物所許葉春研究員、邵強研究員以及武漢病毒所張磊砢研究員為共同通訊作者。該項工作得到了上海同步輻射光源的支持,獲得了國家自然科學基金、中國科學院戰略性先導科技專項、上海藥物所自主部署項目、國家重點研發計劃、廣州國家實驗室重大項目和湖北省重點研發計劃等項目的支持。

