上海有機所發現聚糖分子調控帕金森病致病蛋白相變聚集并抑制其病理毒性
文章來源:上海有機化學研究所 | 發布時間:2024-10-25 | 【打印】 【關閉】
在阿爾茲海默病和帕金森病等神經退行性疾病的病理條件下,致病淀粉樣蛋白(如:Tau和α-syn)通過液-固相變聚集形成病理淀粉樣纖維聚集體,是相應疾病的核心病理標志及重要的診斷和治療靶點。近年研究發現,細胞內多種生物活性分子(如核酸、脂質以及代謝物)對于病理蛋白聚集具有動態調控作用,在疾病的發生發展中起到重要作用。然而,針對生物體中執行生物學功能的另一類重要生物分子-糖類分子是否以及如何調控蛋白病理性聚集的研究相對匱乏。
近期,中國科學院上海有機化學研究所劉聰課題組與俞飚課題組合作,針對“聚糖分子如何調控病理蛋白聚集”這一核心科學問題,在Nature Structural & Molecular Biology發表了題目為Time-course remodeling and pathology intervention of α-synuclein amyloid fibril by heparin and heparin-like oligosaccharides的研究論文,首次發現了肝素多糖能夠結合帕金森病致病蛋白α-syn的病理纖維聚集體并動態重塑其纖維結構的現象,并闡釋其在疾病中的作用。進一步,該研究通過高通量篩選成功獲得具有競爭肝素多糖結合α-syn纖維,同時抑制α-syn病理聚集及神經元毒性的寡糖分子。這項工作開辟了運用寡糖活性分子調控病理蛋白聚集及病理毒性的新方向,為靶向蛋白病理聚集的神經退行性疾病藥物設計提供了新分子和新思路。

成熟的病理蛋白纖維聚集體由于存在大量分子間氫鍵和疏水相互作用被普遍認為具有超穩定的剛性結構。然而,在本工作中,研究人員發現將成熟的α-syn纖維聚集體與肝素多糖(一種高度負電性的聚糖)孵育后,纖維的結構會隨著時間的推移而發生演變。有趣的是,α-syn分子沿纖維軸的排列逐漸發生演變,隨著肝素多糖的孵育時間延長,α-syn纖維的螺旋逐漸被壓縮,相鄰兩層α-syn單體之間的扭轉角逐漸增大(圖1a,b)。構成纖維的每一層α-syn單體在結合肝素多糖后也發生局部的構象變化,如無序的N端片段變得有序,局部氨基酸殘基發生翻轉(圖1c)。這些現象表明,肝素多糖具有重塑淀粉樣纖維結構的能力。此外,研究人員發現,肝素多糖還能夠與成熟的Tau纖維(阿爾茲海默病的關鍵病理聚集體)結合,并引發纖維螺旋的壓縮。因此,肝素多糖具有重塑多種不同病理聚集體的能力,并可能通過識別及重塑蛋白病理聚集體來調控其與細胞膜的結合、內吞,以及胞內病理性擴增。
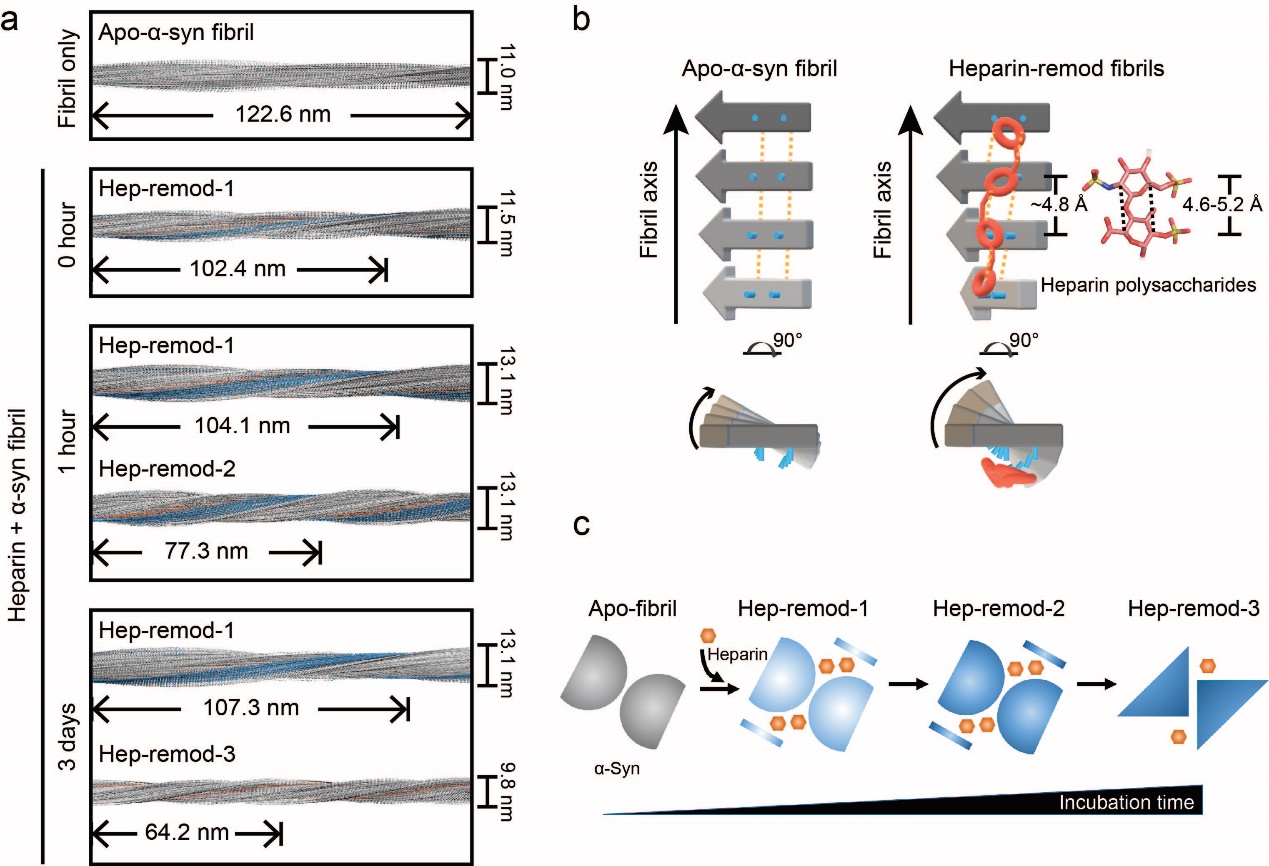
圖1 肝素多糖對成熟α-syn纖維的時序重塑
進一步,研究人員試圖尋找能夠阻斷肝素多糖與α-syn纖維結合的糖類分子。通過化學合成,研究人員建立了肝素類寡糖庫(由1-5個單糖單元構成),并通過高通量競爭篩選實驗,在寡糖庫中篩選獲得了兩種能夠競爭肝素多糖的寡糖活性分子(圖2)。寡糖-α-syn纖維識別機制研究揭示了糖單元上的硫酸化修飾模式和糖單元的數目決定其與纖維聚集體的結合能力。更為重要的是,篩選獲得的肝素類寡糖活性分子能夠有效抑制病理纖維聚集體的形成,并阻斷其與神經元細胞膜的結合及在神經元細胞間的病理性傳播(圖3)。因此,寡糖活性分子具備作為抑制病理性α-syn聚集毒性的先導藥物分子研發的潛力。
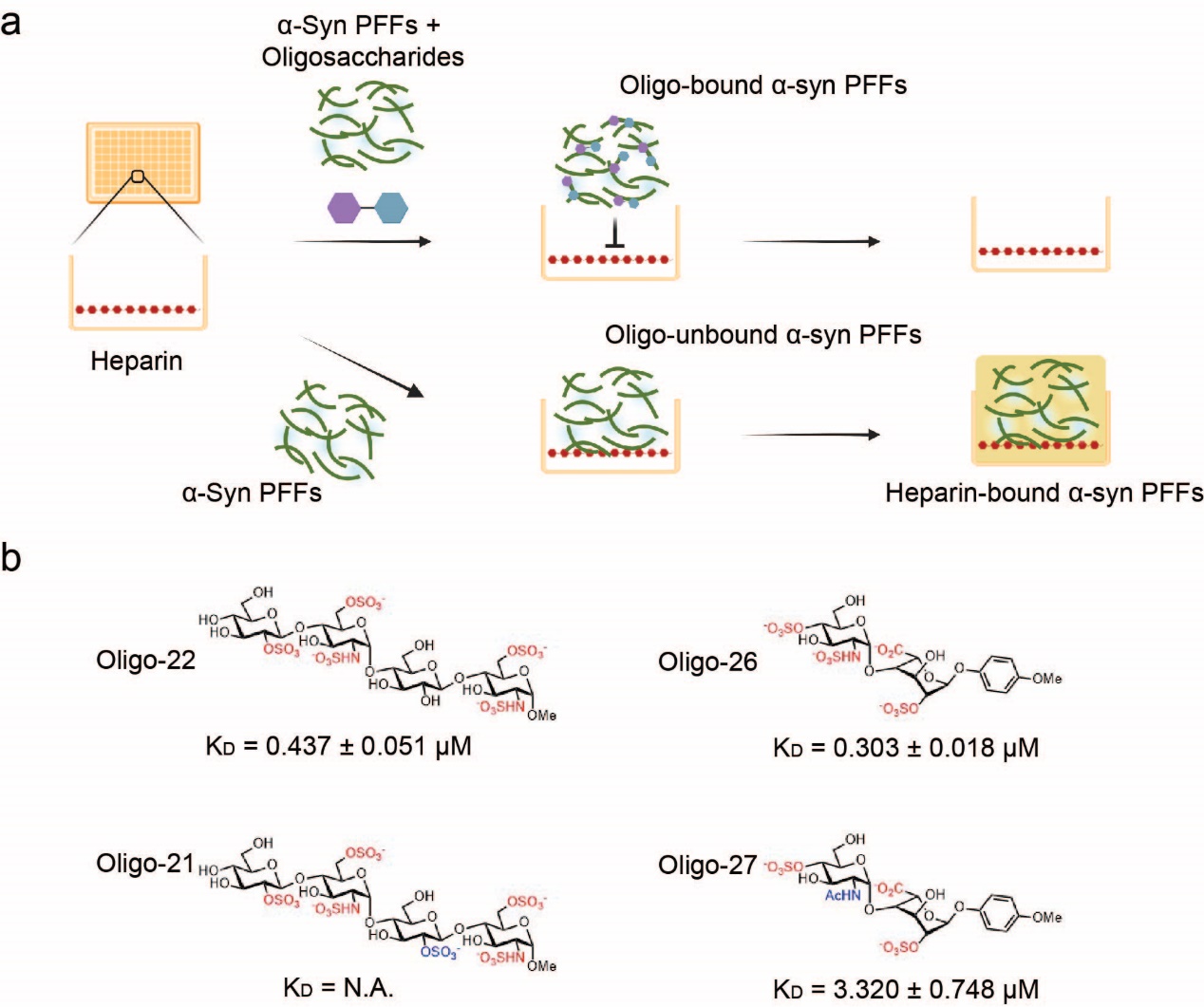
圖2 結合α-syn纖維的寡糖活性分子篩選
綜上,此項研究通過綜合運用化學生物學、生物物理學和細胞生物學等技術手段,發現了肝素多糖對病理性淀粉樣蛋白聚集的時序重塑能力;揭示了成熟的病理纖維聚集體仍可以在與活性多糖分子的相互作用過程中發生結構演化,進而改變其病理活性;首次報道了寡糖分子在調控病理聚集體的形成以及毒性中的重要作用,并為基于寡糖活性分子的神經退行性疾病藥物研發提供了全新的思路。
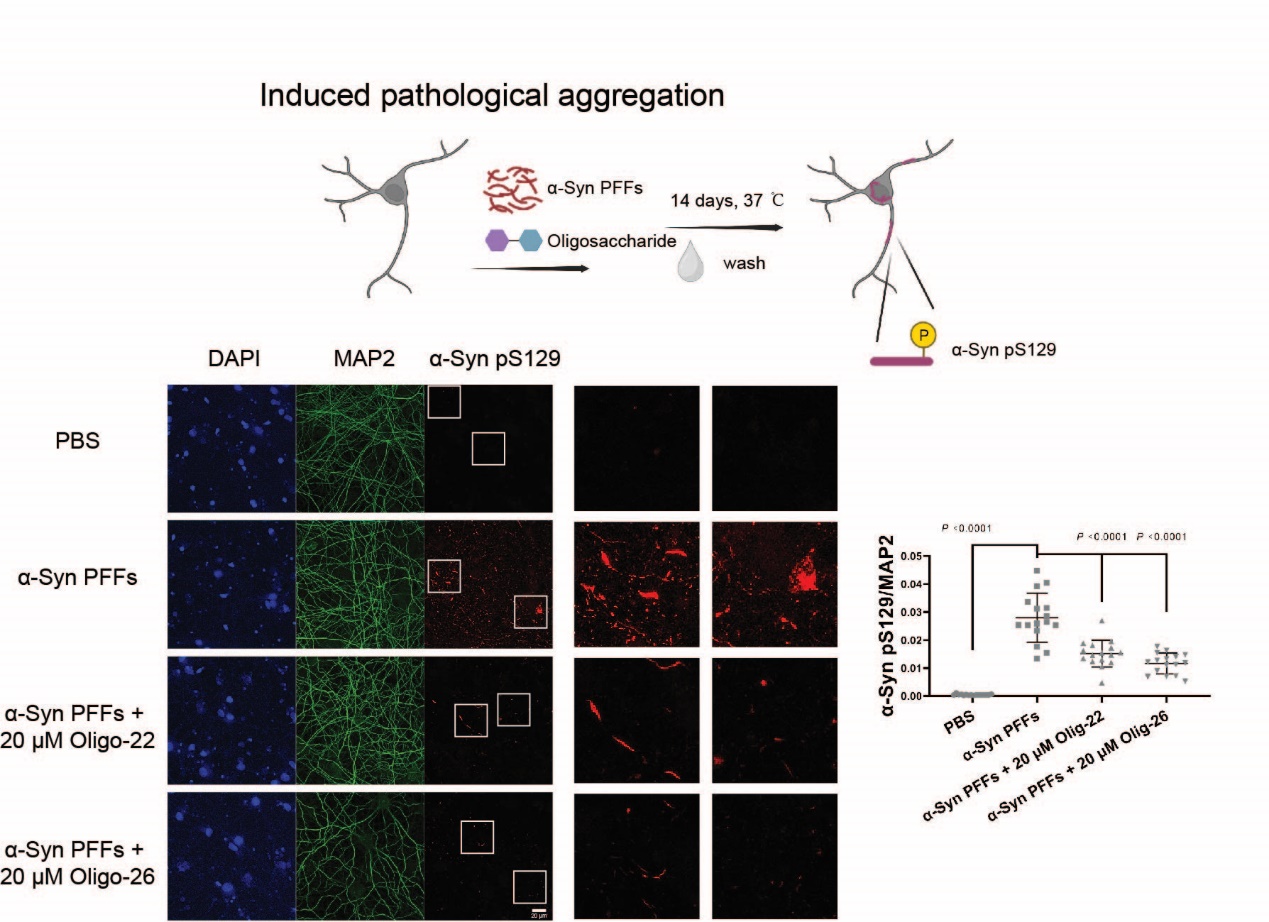
圖3 寡糖活性分子抑制α-syn在神經元中的病理性擴增
上海交通大學Bio-X研究院的陶友琦博士,中國科學院上海有機化學研究所的徐鵬副研究員,為該論文的共同第一作者。俞飚研究員與劉聰研究員為共同通訊作者。此項工作受到國家自然科學基金委、科技部、中國科學院、上海市科委的資助。
論文鏈接:https://www.nature.com/articles/s41594-024-01407-2
